1989年,中國開始引入醫療器械市場準入的概念,醫療器械新產品需行政審查才可上市;1992年,借鑒歐洲的監管模式,中國啟動醫療器械產品安全認證工作;1996年,原國家醫藥管理局發布《醫療器械產品注冊管理辦法》,正式規定未經注冊的醫療器械不得進入市場;2000年,國務院頒布《醫療器械監督管理條例》(國務院令276號)作為中國的專項行政法規,明確規定實施醫療器械注冊管理制度,中國醫療器械監管進入新的發展階段。
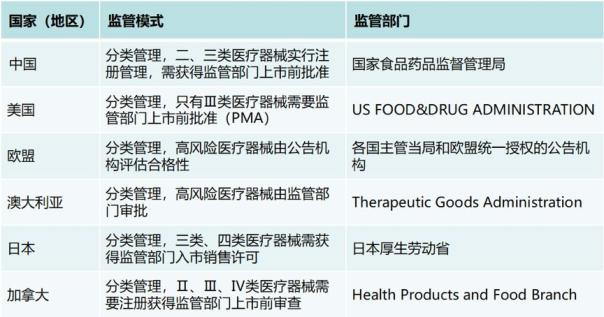
國內外醫療器械監管模式與監管部門對比
2014版《醫療器械監督管理條例》(國務院令650號)于2014年6月1日起施行,體現了國務院關于建立最嚴格的覆蓋全過程的監管制度、深化行政審批制度改革和推進政府職能轉變的精神。與舊版條例相比,新條例在完善分類管理、適當減少事前許可、加大企業責任、強化日常監督等方面做出了較大修改,主要特點如下:
1. 明確醫療器械分類管理按照風險高低程度分類;
2. 放開第一類醫療器械的經營,第二類醫療器械經營改為備案;
3. 第一類醫療器械改為備案管理,第二、三類繼續實行注冊審批管理;
4. “先申請生產許可證后申請產品注冊證”改為“先申請產品注冊證后申請生產許可證”,減少審批前行政許可事項同時降低企業成本,舊條例規定的16項行政許可降至9項;
5. 強化日常監管職責,增設醫療器械不良事件監測制度、醫療器械延續注冊制度、醫療器械召回制度,通過提高處罰幅度、增加處罰種類加大違法行為的處罰力度;
6. 首次明確藥監部門和衛生主管部門分別依據各自職責對醫療器械進行監督管理;
7. 明確了申請注冊時應提交的資料和文件以及產品注冊申請部門,規定第一類醫療器械提交的資料不包括臨床試驗報告。
除了從上位法加強對醫療器械的監管,我國還發布了創新醫療器械特別審批程序、 醫療器械優先審批程序和免于進行臨床試驗醫療器械目錄等措施提高醫療器械審批效率。也加強了醫療器械上市后和經營、使用環節的監管,2018年監管部門將繼續加強醫療器械上市后監管工作,制定一系列規章規范性文件。包括嚴查網絡經營和銷售活動,加強醫療器械現場檢查并加大處罰力度和改進抽檢工作等。圍繞保障醫療器械安全有效這一核心目標,監管部門科學提質提速審評審批制度,更細更嚴監管醫療器械全生命周期。
2018年監管部門計劃制定的規章規范性文件







